押さえておきたい!がん臨床試験用語集 ◇第1弾:臨床試験の試験設定に関連する用語◇
分子標的薬やがん免疫療法の登場は、がんの薬物療法を大きく変えました。薬剤の選択肢が限られていた癌腫や、再発・転移の患者さんに対しても有用な薬剤が承認されています。使用できる薬剤や治療ラインが増えたことで後治療が許容されたがん臨床試験では、以前のように被験薬群と対照薬群のOS やPFS の数値を単純に比較しただけではデータの解釈が難しい場合がみられるようになりました。
そのため、後治療を考慮した新たな評価項目を使用した臨床試験成績が報告されています。
本コンテンツでは、臨床試験成績を読み解くうえで押さえておきたい用語を2回に分けて横浜市立大学医学部 耳鼻咽喉科・頭頸部外科学 主任教授 折舘 伸彦先生にご解説頂きました。
臨床試験の試験設定に関連する用語
※下記の用語をクリックいただくと該当箇所に移動します。
仮説検定
事前に立てたある仮説(例:新しい薬剤が従来の薬剤より有効性が高い)が真であるかどうかを確認するためにデータを集めて確かめるもの。仮説には、帰無仮説(否定したい仮説)と対立仮説(証明したい仮説)がある。
帰無仮説と対立仮説
帰無仮説とは、群間に差がなく、観察された2群の差は偶然にすぎないという仮説であり、P値はこの帰無仮説が真である場合に、実際に観察された、あるいはそれ以上の差が観察される確率である。
P値が非常に小さい場合、帰無仮説は正しくない(偶然ではない)と判断(棄却)され、2群に有意な差があると考える。帰無仮説が棄却されることで結果的に成り立つものが、対立仮説である。
統計学的有意差
統計学的に有意とは、仮説と実際に観察された結果との差が、偶然や誤差によって生じたものではないことを意味する。有意であるかどうかの基準(有意水準)は試験によって異なり、統計的解析を行う前に設定する必要がある。
有意水準(significance level, α)
P値がどれくらい小さければ有意と判断するかの閾値。
有意水準は試験によって異なるが、多くの臨床試験で有意水準は0.05(5%)と設定され、P値がその値以下(P<0.05)であれば2群間に有意差があると判断される。なお、有意水準を上回った(P≧0.05)場合、『差がない』というわけではなく、『差があるとは言えない』ということを意味する。
評価項目(エンドポイント)
臨床試験の目的に対して、臨床的に最も適切で説得力のある証拠を与える指標/項目。
患者の利益を直接反映する項目を『真のエンドポイント』、真のエンドポイントの直接的な測定が難しく、その代わりとなる項目を『代替えエンドポイント』という。(例:高脂血症の場合、真のエンドポイントは冠動脈疾患による死亡、代替えエンドポイントはLDLコレステロール値)
また、エンドポイントは、死亡のように測定方法の影響を受けずに同じ結果が得られる『ハードエンドポイント』、QOL評価のように測定する人や施設によって変動する『ソフトエンドポイント』の2種類に分けられる。
主要評価項目(Primary Endpoint)(一次エンドポイント)
試験の主要な目的に直結し、最も重要で関心のある項目。通常は、ひとつに絞って設定されるが、複数の主要評価項目を設定する試験もある。
副次的評価項目(Secondary Endpoint)(二次エンドポイント)
主要評価項目を支持する補足的な項目。主要評価項目とは異なる視点から有効性を評価し、副次的な目的に関連した項目であり、ひとつでなくてもよい。
探索的評価項目(Exploratory Endpoint)
主要評価項目、副次的評価項目では評価できない被験薬との関連性を検討する項目。
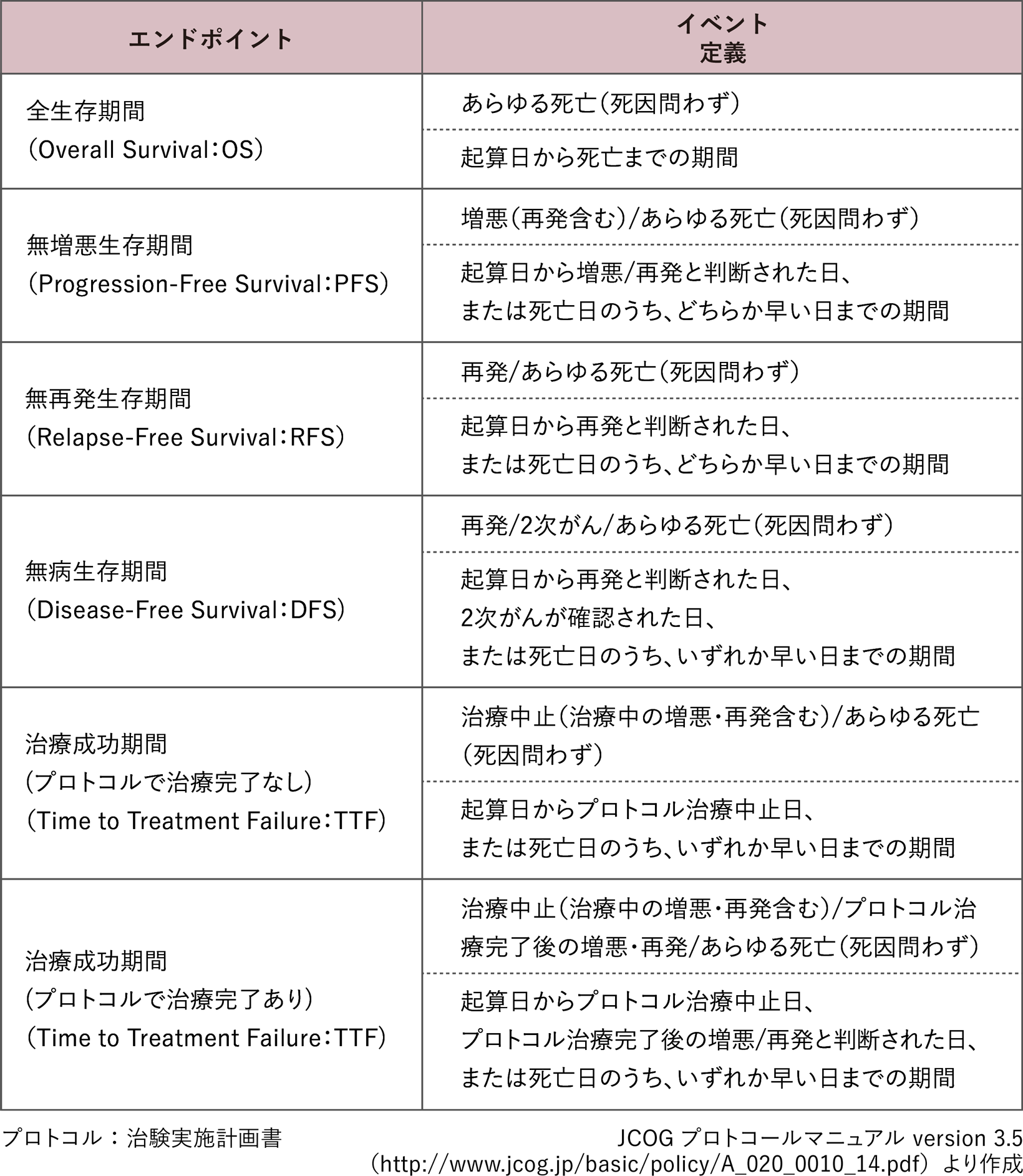
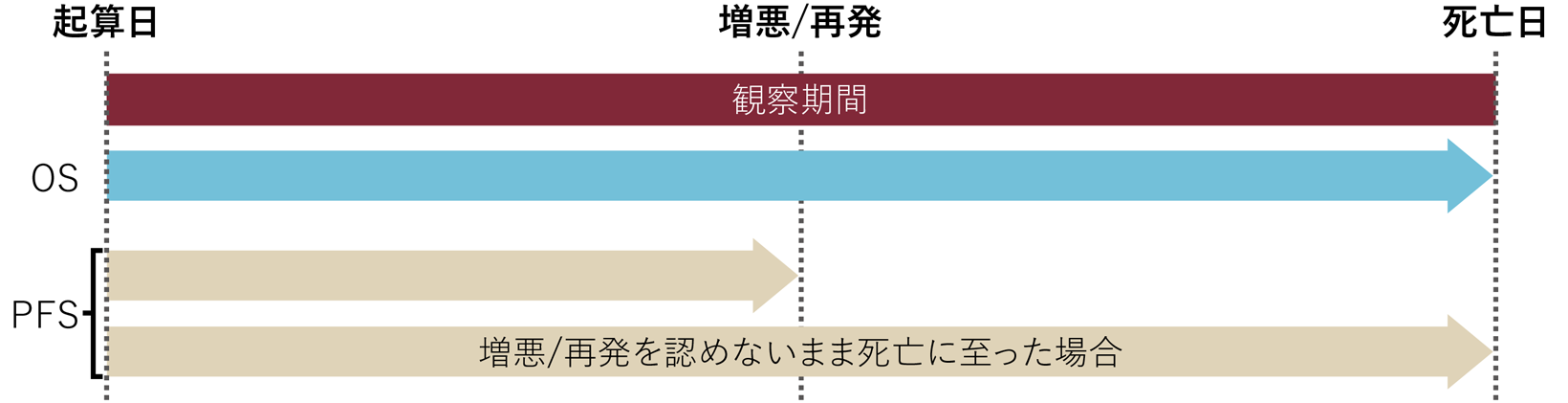
生存時間解析に関連するエンドポイント
腫瘍縮小効果に関連するエンドポイント
奏効率(Overall Response Rate:ORR)
治療を受けた患者数を分母として、CR(完全奏効)とPR(部分奏効)を示した症例を合わせた割合。

病勢制御率、病勢コントロール率(Disease Control Rate:DCR)
CRとPRの合計である奏効率にSD(安定)を加えた割合。通常、SDは奏効には該当しないが腫瘍を増大させていないという点で、効果を発揮しているという考えから評価項目として用いられる。

奏効期間(Duration Of Response:DOR)
CRまたはPR(最初に記録された方)の測定規準が最初に満たされた時点から、再発または増悪が客観的に確認された最初の日までの期間。
無増悪期間(Time to Tumor Progression:TTP)
起算日(ランダム割付日)または治療開始日から増悪が客観的に確認される、または増悪による死亡(現病死)までの期間。
安定期間(Duration of stable disease)
経過中の径和の最小値を比較対照として(ベースラインの径和が最小の場合はこれを比較対照とする)、治療開始(ランダム化試験の場合、ランダム割付日)から増悪の規準が満たされた時点までの期間とする。
奏効に至るまでの期間(Time To Response:TTR)
ランダム割付日からPR以上の奏効が最初に確認された日までの期間。
層別因子(stratification factors)
比較試験の割り付け(ランダム化)の際に、あらかじめ優先的に群間で均等にする因子。がんの臨床試験で設定される層別因子の数は、3つまでが一般的である。
クロスオーバー(交差)試験
対象患者を2群に分け、各群で別々の治療を行い評価した後に、各群の治療法を交換して再度評価する方法。
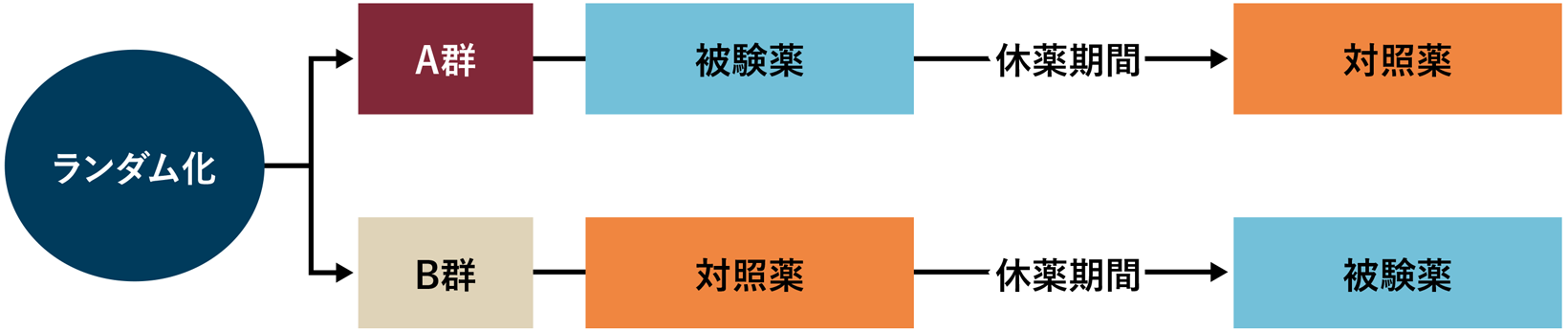
このデザインの利点は、同一患者で薬剤を比較するため精度が高い、少ない患者数で行う、などがある。欠点は、試験期間が長い、休薬期間をおいても先に投与した薬の効果を持ち越す(持ち越し効果)場合は、解析や解釈が複雑となる。
また、がん臨床試験では、実薬(被験薬)群とプラセボ(対照薬)群に分けた比較試験で、プラセボ群の患者に病勢進行が見られた場合、倫理的な観点から実薬への変更するようにしたデザインもクロスオーバーという。
フォローアップ(追跡)期間
追跡期間とは、臨床試験で事前に定められたデータ収集の対象となる期間。
層別解析(stratified analysis)
治療群間で背景因子に従って患者をグループ(層)分けし、それぞれの層で治療群間を比較する解析。
なお、サブグループ解析は、試験に参加した患者全体のうち、ある特定の集団(例:前治療歴を有する)に注目し、その集団(サブグループ)を対象として行う解析。
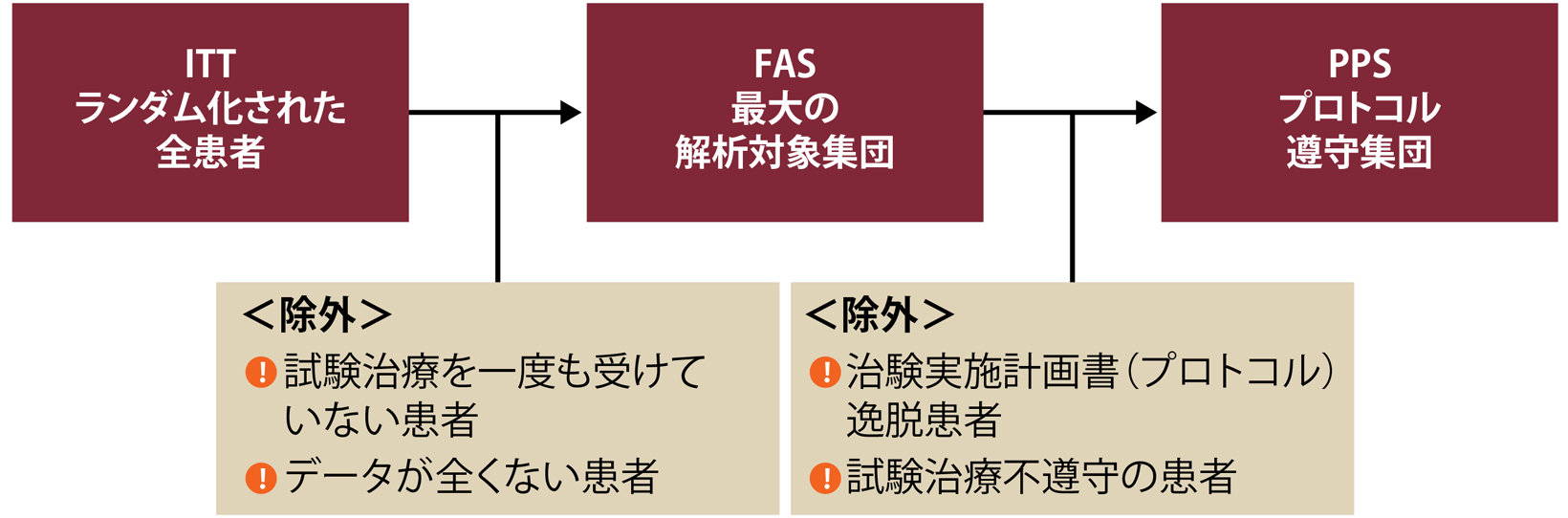
ITT(Intention To Treat)解析
最初に割り付け(ランダム化)された全患者を対象として解析する方法。
ランダム化後の治験実施計画書(プロトコル)からの逸脱が群間で偏っている可能性もあるため、両群で条件がそろうように扱え、広く行われている解析方法。
FAS(Full Analysis Set:最大の解析対象集団)解析
割り付けられた治療を一度も受けていない患者、データが全くない患者を除外して解析する方法。
PPS(Per Protocol Set:プロトコル遵守集団)解析
治験実施計画書(プロトコル)逸脱や試験治療不遵守の患者を除外して解析する方法。
事後解析(post hoc analysis)
臨床試験が完了し、主要評価項目(一次エンドポイント)の解析が終了してから、治験実施計画書(プロトコル)で事前に規定されていなかった評価項目を後から追加で行う解析。
本コンテンツは、以下の書籍などをもとに作成いたしました。
- 〈参考文献〉
-
- JCOG データセンター 訳: 米国SWOG に学ぶ がん臨床試験の実践 第2版, 医学書院, 2013.
- 日本臨床腫瘍学会 編: 新臨床腫瘍学 改訂第5版, 南江堂, 2018.
- 国立がん研究センター内科レジデント 編: がん診療レジデントマニュアル 第7版, 医学書院, 2016.
- 神田 善伸: みんなのEBM と臨床研究, 南江堂, 2016.
- 能登 洋: やさしいエビデンスの読み方・使い方, 南江堂, 2010.
- 佐藤 弘樹, 市川 度: 臨床家と統計家が2 人で書いた 生存時間解析がこれでわかる! 臨床統計まるごと図解,中山書店, 2013.
- Eisenhauer EA, et al. Eur J Cancer. 2009; 45: 228-47.
- 固形がんの治療効果判定のための新ガイドライン(RECIST ガイドライン) ー 改訂版 version 1.1 ー日本語訳JCOG版 ver.1.0
- JCOG プロトコールマニュアル version 3.5(http://www.jcog.jp/basic/policy/A_020_0010_14.pdf)
- 実験医学online. バイオキーワード集(https://www.yodosha.co.jp/jikkenigaku/keyword/index.html)
2023年5月作成


