根治切除不能な進行・再発の上皮系皮膚悪性腫瘍に対するオプジーボの有効性および安全性 根治切除不能な進行・再発の上皮系皮膚悪性腫瘍に対するオプジーボの有効性および安全性

「警告・禁忌を含む注意事項等情報」等はDI ページをご参照ください。
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍を対象とした臨床試験
| 目的 |
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍を対象にオプジーボの有効性及び安全性を検討する。 |
|
|---|---|---|
| 試験デザイン | 多施設共同非盲検非対照第Ⅱ相試験(医師主導試験) | |
| 対象※1 |
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍患者 31例([有棘細胞癌20例、基底細胞癌2例、乳房外パジェット病4例、皮膚付属器癌5例(エクリン汗孔癌3例、汗腺癌1例、皮膚粘液癌1例)] |
|
| 投与方法 | オプジーボ480mgを4週間間隔で点滴静注した。 | |
| 評価項目 | 有効性 |
主要評価項目: 副次的評価項目: |
| 安全性 | 有害事象、臨床検査等 | |
| 解析計画 | 有効性 |
主要評価項目: 副次的評価項目: サブグループ解析: |
- ※1:本試験で対象とされた上皮系皮膚悪性腫瘍は以下の通り 有棘細胞癌、基底細胞癌、皮膚付属器癌(乳房外パジェット病、毛母癌、悪性増殖性外毛根鞘腫瘍、悪性外毛根鞘腫、脂腺癌、汗腺癌、悪性円柱腫、エクリン汗孔癌、腺様嚢胞癌、皮膚粘液癌、悪性らせん腫、悪性結節性汗腺腫、悪性軟骨様汗管腫、侵襲性指状乳頭状腺癌、乳頭状汗管嚢胞腺癌、乳頭状汗管癌、微小嚢胞性付属器癌、汗管腫様癌並びにメルケル細胞癌)及びボウエン病
- ※2:中央判定及び実施医療機関の医師判定
- ※3:RECISTガイドライン1.1版に基づく
- ※4:中央判定
1)小野薬品工業:国内第Ⅱ相(KCTR-D014)試験成績(社内資料) 承認時評価資料
投与方法
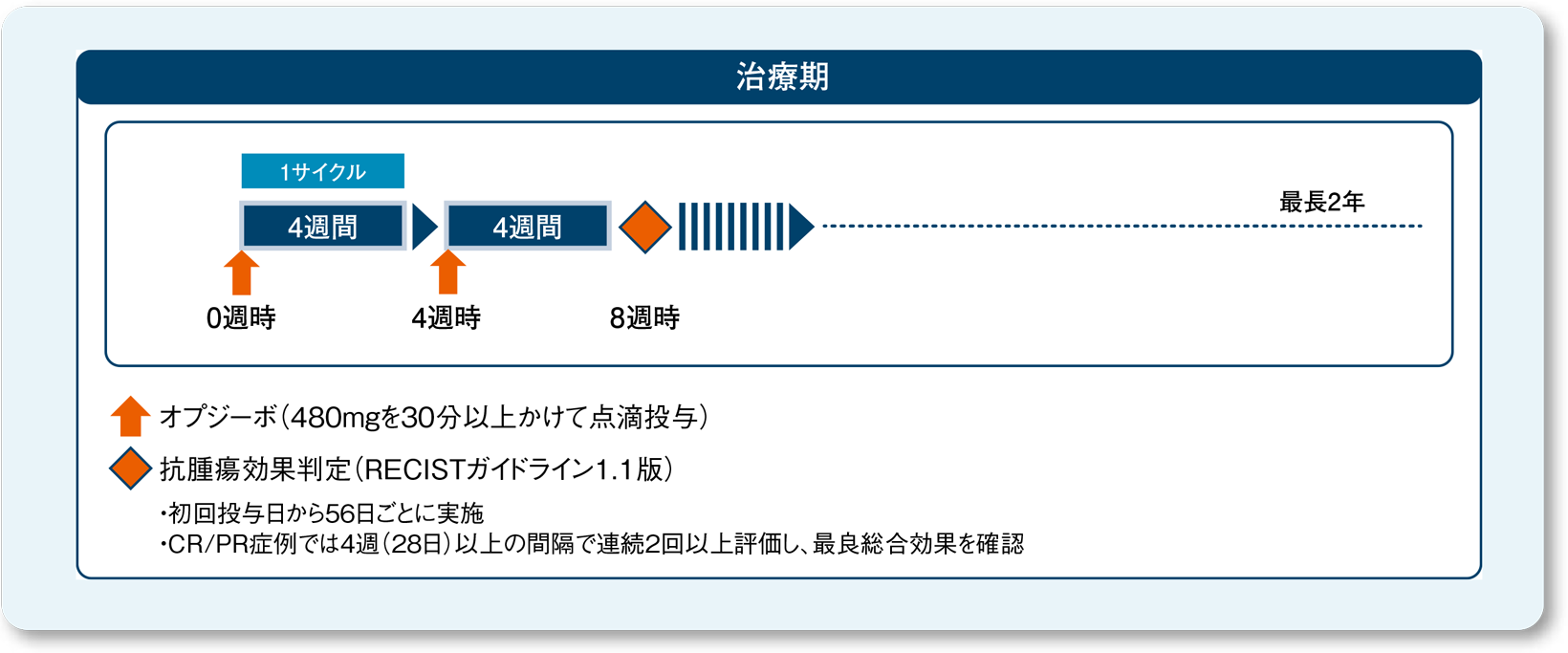
投与期間は最長2年間とした。
4. 効能又は効果(一部抜粋)
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍
5. 効能又は効果に関連する注意(一部抜粋)
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
5.28 メルケル細胞癌患者に対する本剤の有効性及び安全性は確立していない。
5.29 臨床試験に組み入れられた患者の病理組織型等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解し
た上で、適応患者の選択を行うこと。[17.1.32参照]
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
7.21 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
患者背景
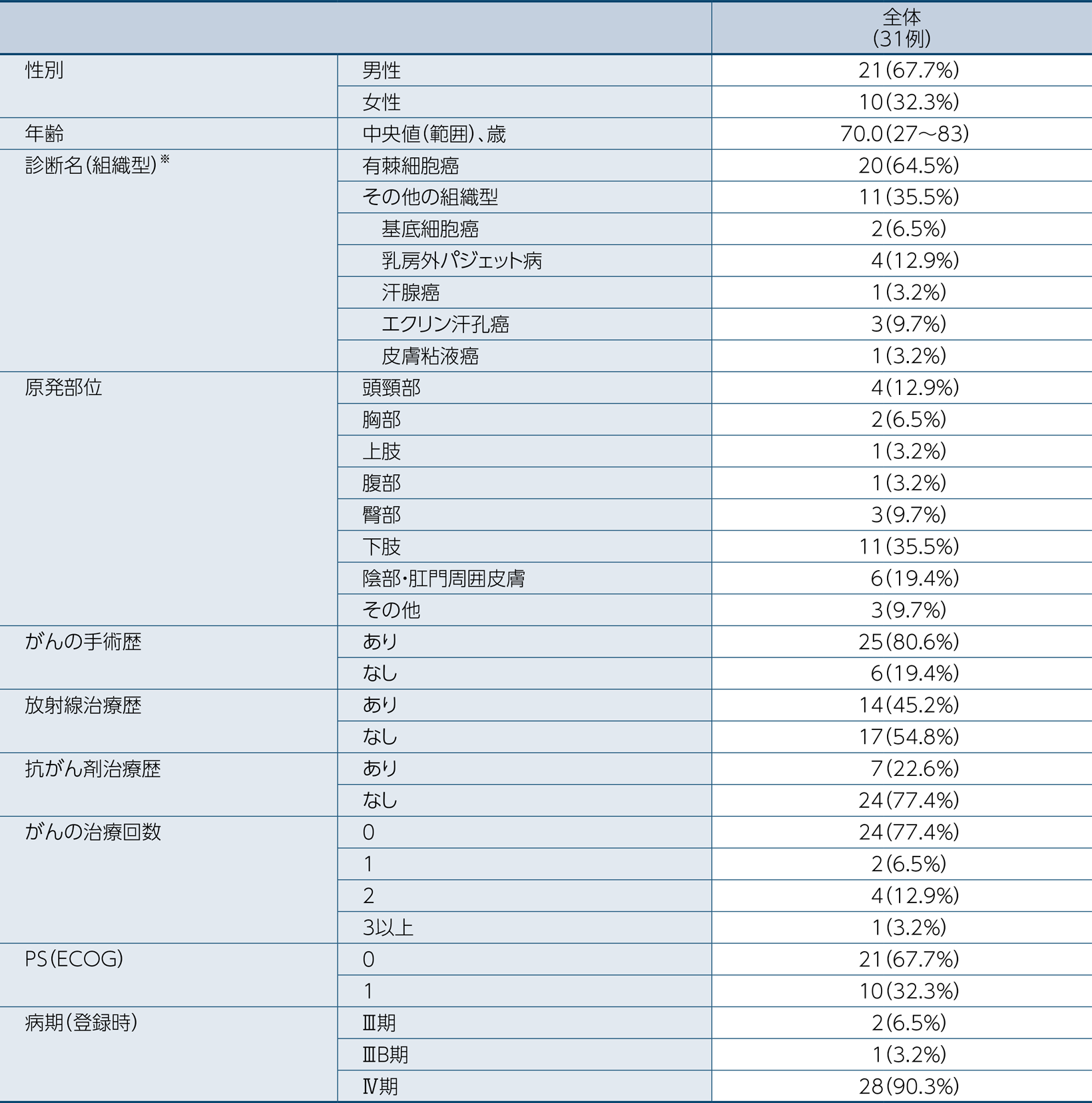
- ※:対象とされた上皮系皮膚悪性腫瘍で試験に登録されなかった疾患は省略した
本試験で対象とされた上皮系皮膚悪性腫瘍は以下の通り 有棘細胞癌、基底細胞癌、皮膚付属器癌(乳房外パジェット病、毛母癌、悪性増殖性外毛根鞘腫瘍、悪性外毛根鞘腫、脂腺癌、汗腺癌、悪性円柱腫、エクリン汗孔癌、腺様嚢胞癌、皮膚粘液癌、悪性らせん腫、悪性結節性汗腺腫、悪性軟骨様汗管腫、侵襲性指状乳頭状腺癌、乳頭状汗管嚢胞腺癌、乳頭状汗管癌、微小嚢胞性付属器癌、汗管腫様癌並びにメルケル細胞癌)及びボウエン病
4. 効能又は効果(一部抜粋)
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍
5. 効能又は効果に関連する注意(一部抜粋)
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
5.28 メルケル細胞癌患者に対する本剤の有効性及び安全性は確立していない。
5.29 臨床試験に組み入れられた患者の病理組織型等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解し
た上で、適応患者の選択を行うこと。[17.1.32参照]
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
7.21 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
有効性
データカットオフ2021年9月17日時点の有効性・安全性を掲載します。
奏効率(ORR)[中央判定] 〔主要評価項目〕
病勢コントロール率(DCR;CR+PR+SD)[中央判定] 〔副次的評価項目〕
最良総合効果(BOR)[中央判定] 〔副次的評価項目〕
奏効率(ORR)は19.4%(95%信頼区間[7.5, 37.5]※)であり、95%信頼区間の下限値は、事前に設定した閾値の5%を上回りました。
病勢コントロール率(DCR)は54.8%(95%信頼区間[36.0, 72.7]※)でした。
最良総合効果(BOR)は、31例中CRが0例(0%)、PRが6例(19.4%)、SDが11例(35.5%)、PDが9例(29.0%)及びNEが5例(16.1%)でした。
なお、抗腫瘍効果はRECISTガイドライン1.1版に基づき中央判定しました。
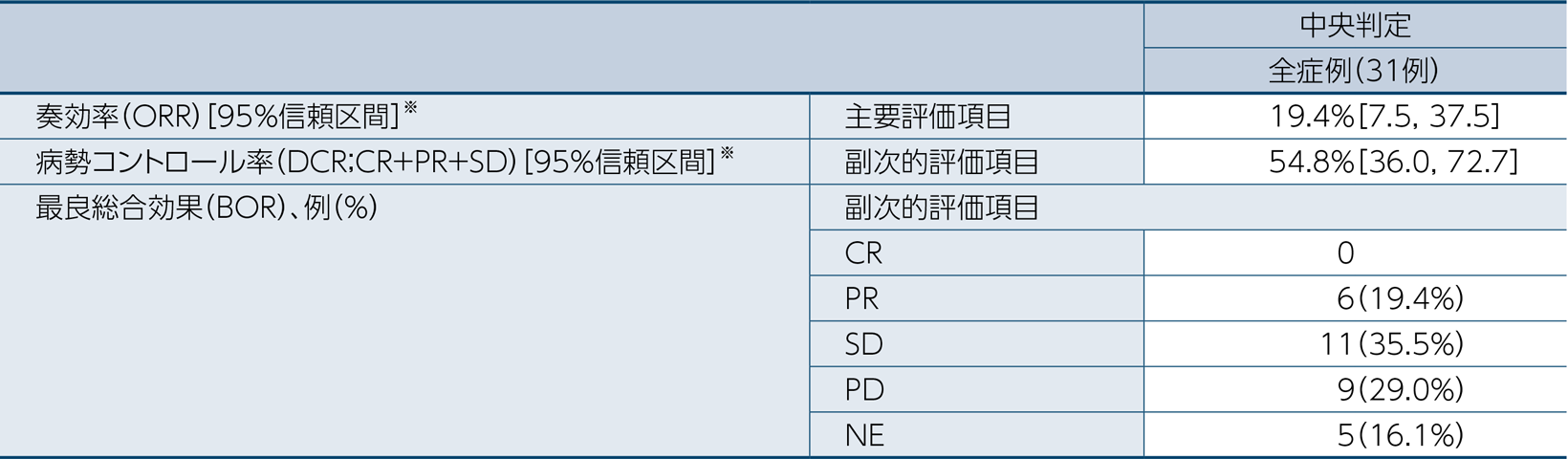
※:Clopper-Pearson法
奏効率(ORR)[中央判定] 〔主要評価項目〕〔サブグループ解析〕
奏効率(ORR)のサブグループ解析は以下の通りでした。
なお、抗腫瘍効果はRECISTガイドライン1.1版に基づき中央判定しました。
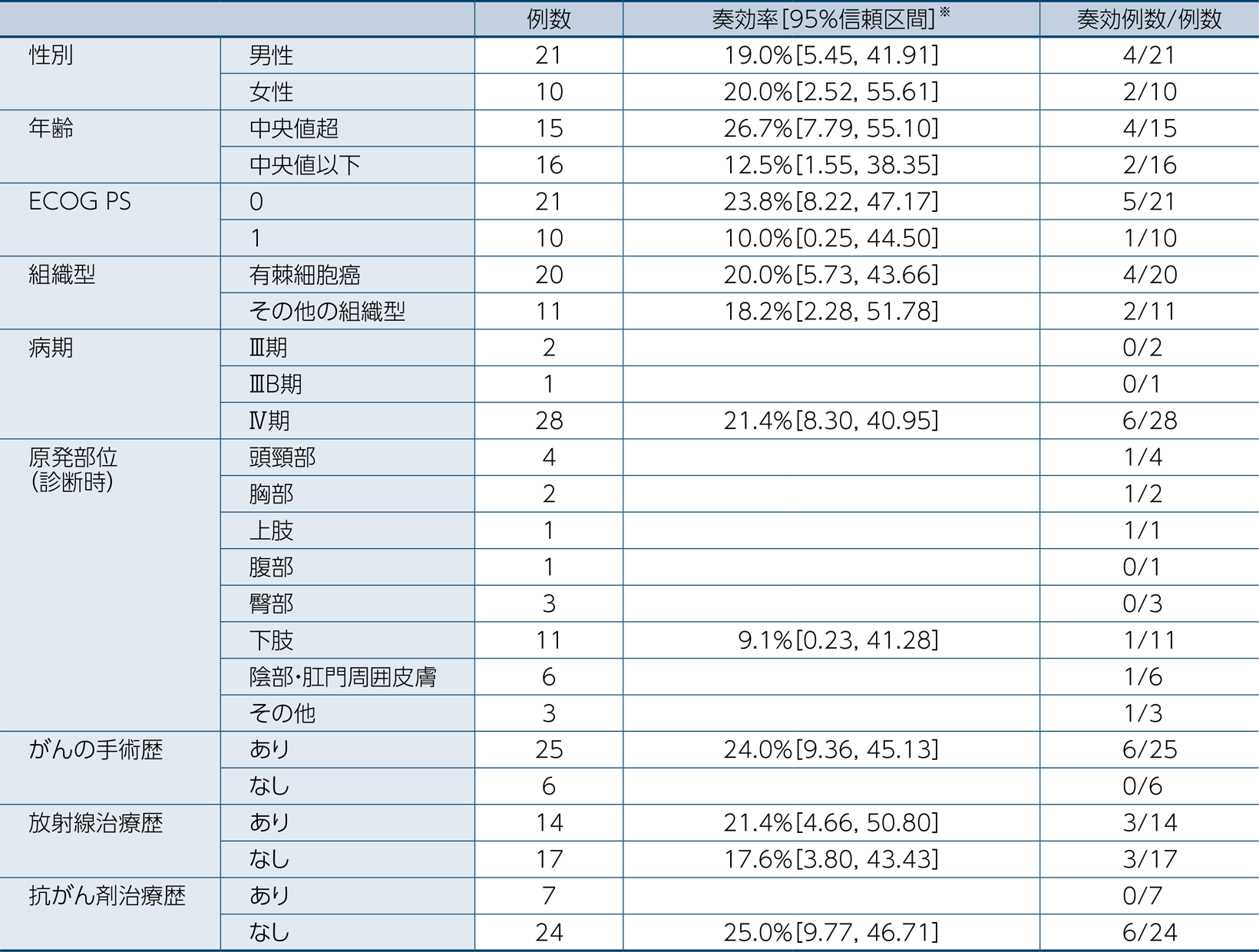
10例以上の項目のみ奏効率[95%信頼区間]を記載した
※:Clopper-Pearson法
奏効率(ORR)[中央判定] 〔主要評価項目〕〔サブグループ解析〕
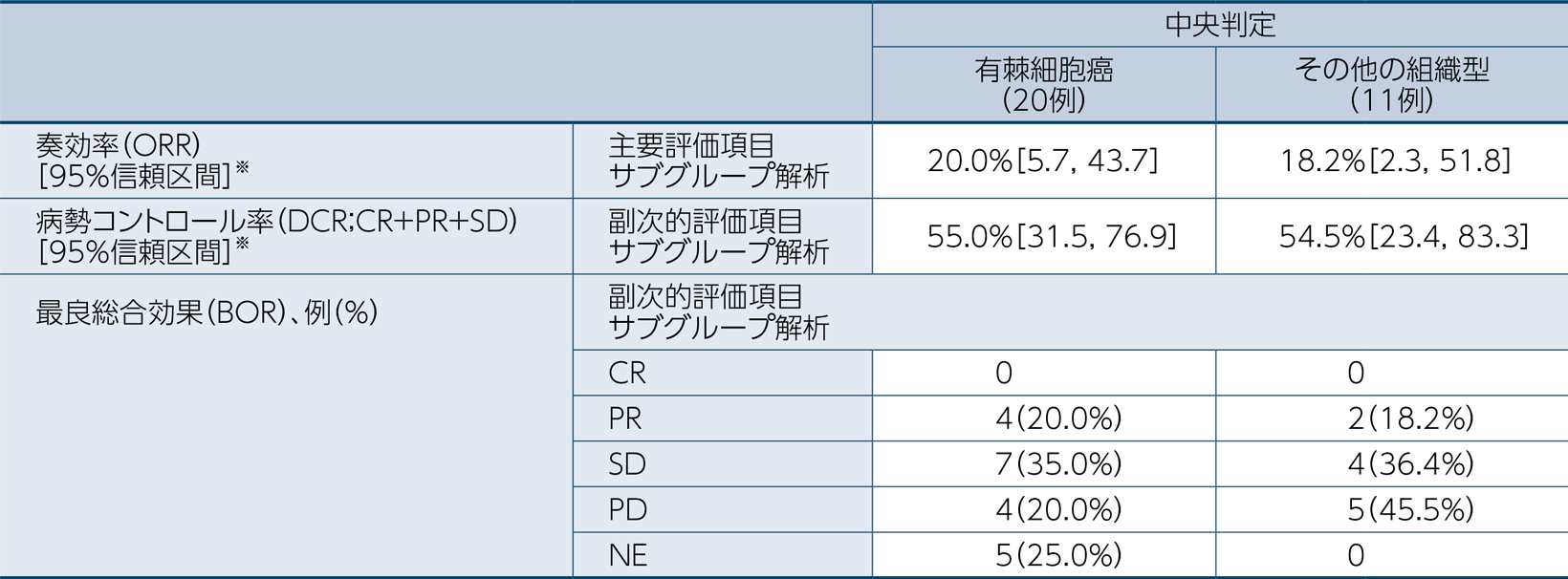
ORR(中央判定)について、組織型別(有棘細胞癌20例、基底細胞癌2例※1、乳房外パジェット病4例※1、皮膚付属器癌5例※1)のサブグループ解析結果を以下に示します。
なお、抗腫瘍効果はRECISTガイドライン1.1版に基づき中央判定しました。
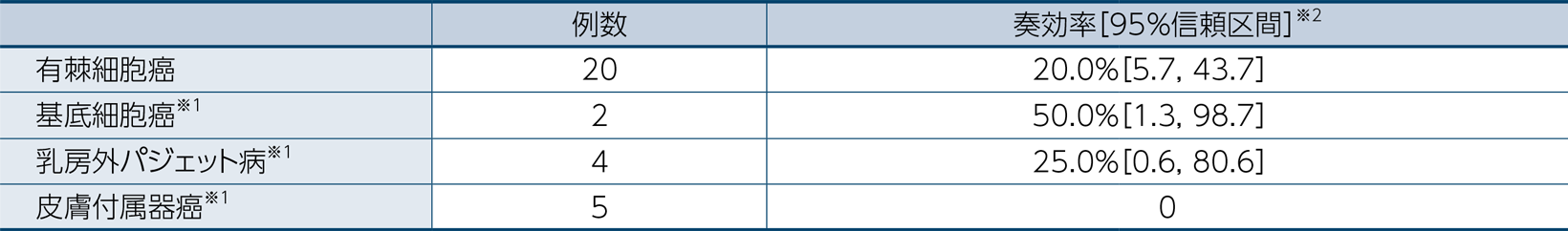
- ※1:本解析は統計解析計画書にて規定された解析ではないものの、承認審査過程で評価を受け、かつ医薬品医療機器総合機構に情報提供を求められたため、10例未満であるが奏効率を記載した
- ※2:Clopper-Pearson法
奏効率(ORR)[実施医療機関の医師判定] 〔副次的評価項目〕
病勢コントロール率(DCR;CR+PR+SD)[実施医療機関の医師判定] 〔副次的評価項目〕
最良総合効果(BOR)[実施医療機関の医師判定] 〔副次的評価項目〕
奏効率(ORR)は25.8%(95%信頼区間[11.9, 44.6]※)でした。
病勢コントロール率(DCR)は64.5%(95%信頼区間[45.4, 80.8]※)でした。
最良総合効果(BOR)は、31例中CRが4例(12.9%)、PRが4例(12.9%)、SDが12例(38.7%)、PDが10例(32.3%)及びNEが1例(3.2%)でした。
なお、抗腫瘍効果はRECISTガイドライン1.1版に基づき実施医療機関の医師が判定しました。
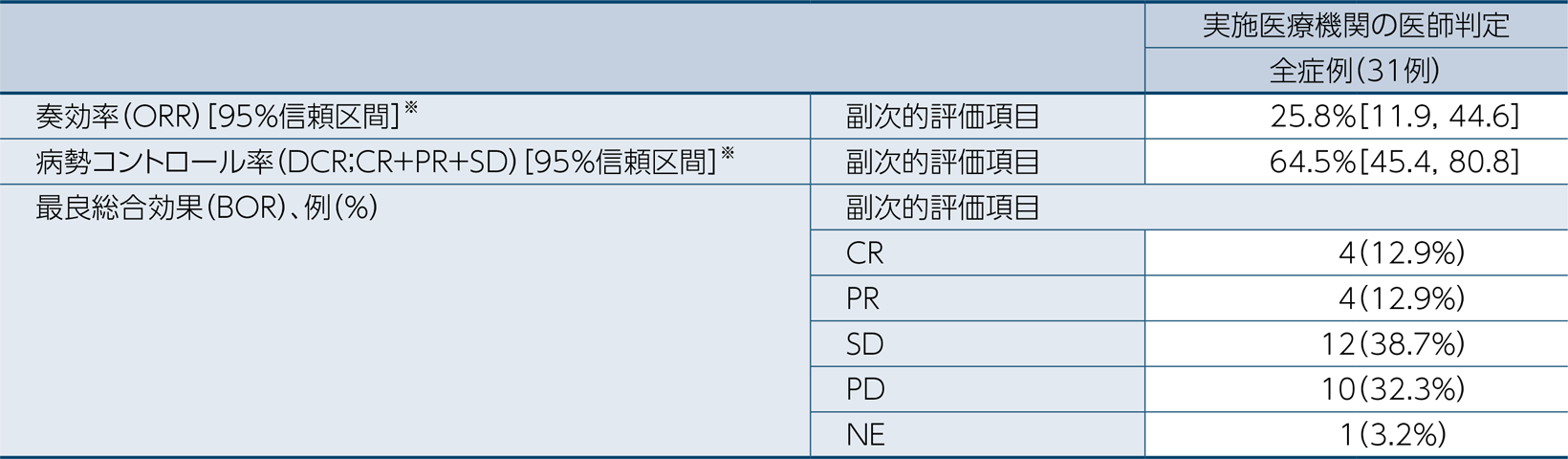
※:Clopper-Pearson法
4. 効能又は効果(一部抜粋)
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍
5. 効能又は効果に関連する注意(一部抜粋)
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
5.28 メルケル細胞癌患者に対する本剤の有効性及び安全性は確立していない。
5.29 臨床試験に組み入れられた患者の病理組織型等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解し
た上で、適応患者の選択を行うこと。[17.1.32参照]
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
7.21 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
全生存期間(OS) 〔副次的評価項目〕
全生存期間(OS)の中央値は17.77ヵ月(95%信頼区間[10.48, -]※1)でした。
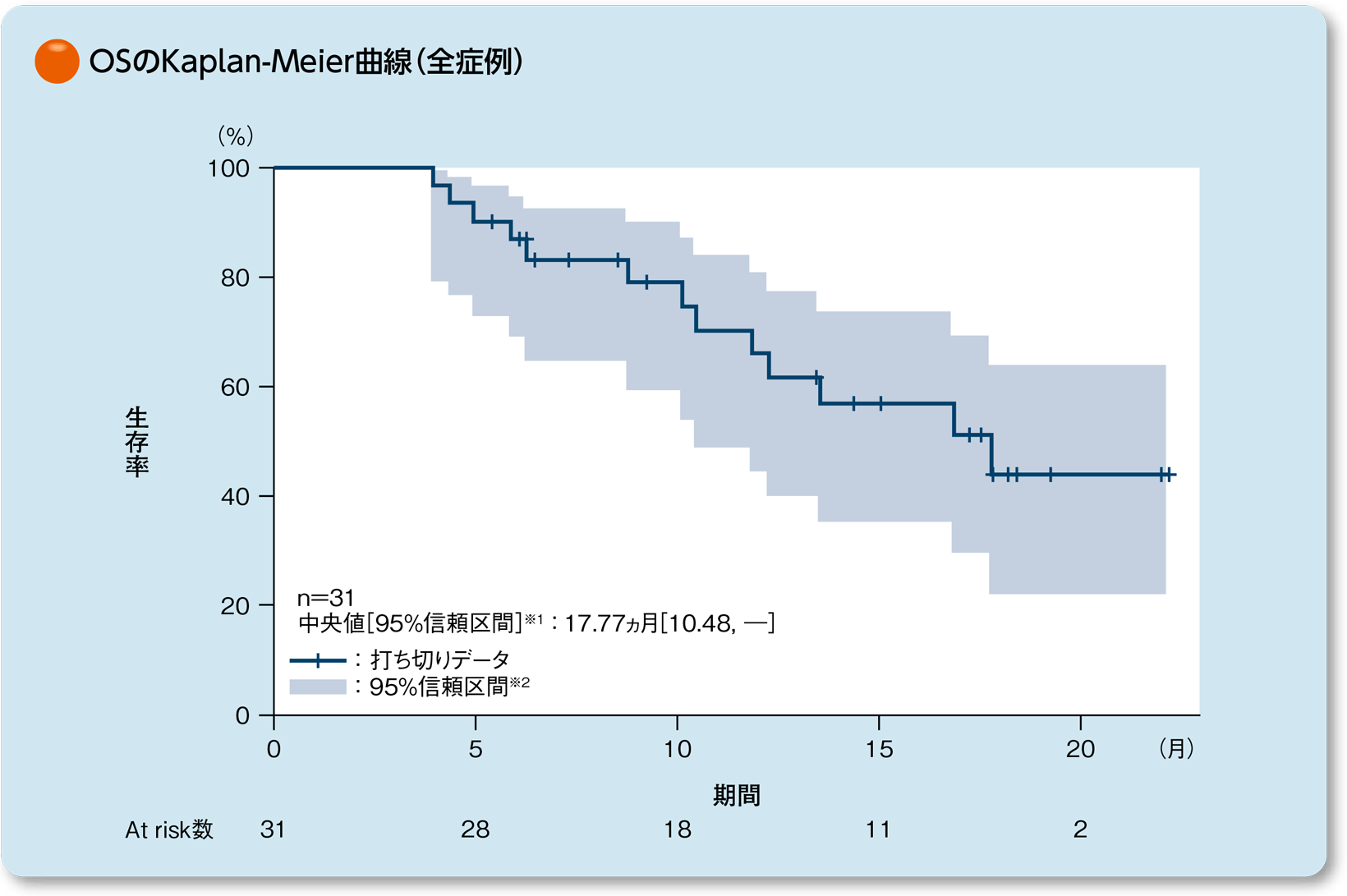
- ※1:Kaplan-Meier法
- ※2:Greenwoodの公式
無増悪生存期間(PFS)[中央判定] 〔副次的評価項目〕
無増悪生存期間(PFS)の中央値は4.16ヵ月(95%信頼区間[3.52, 5.55]※1)でした。
なお、抗腫瘍効果はRECISTガイドライン1.1版に基づき中央判定しました。
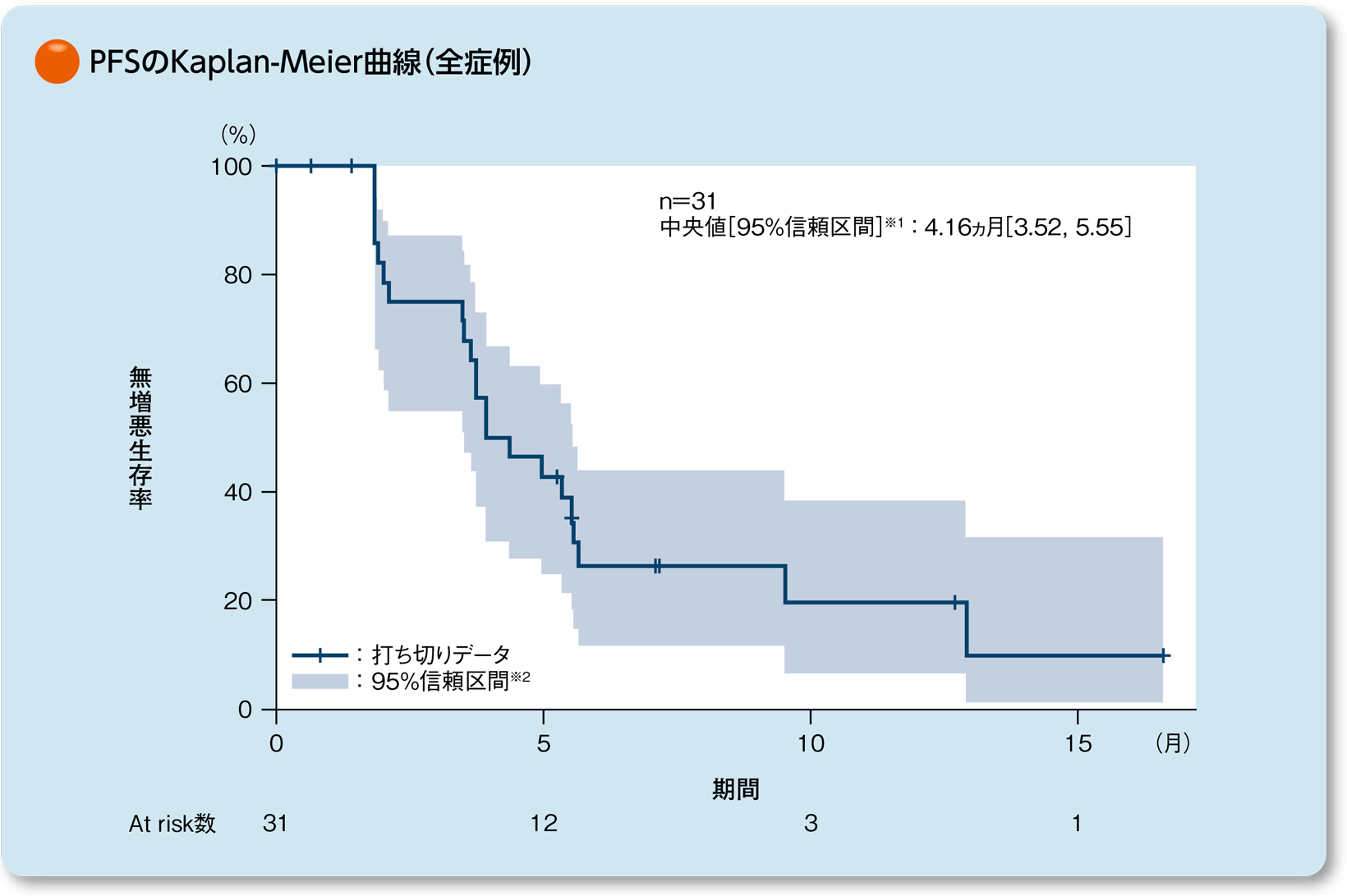
- ※1:Kaplan-Meier法
- ※2:Greenwoodの公式
奏効期間(DOR)[中央判定] 〔副次的評価項目〕
奏効に至るまでの期間(TTR)[中央判定] 〔副次的評価項目〕
奏効期間(DOR)の中央値は7.75ヵ月(95%信頼区間[3.71, -]※)でした。
また、奏効に至るまでの期間(TRR)の中央値は未達(95%信頼区間[-, -]※)でした。
なお、抗腫瘍効果はRECISTガイドライン1.1版に基づき中央判定しました。

※:Kaplan-Meier法
4. 効能又は効果(一部抜粋)
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍
5. 効能又は効果に関連する注意(一部抜粋)
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
5.28 メルケル細胞癌患者に対する本剤の有効性及び安全性は確立していない。
5.29 臨床試験に組み入れられた患者の病理組織型等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解し
た上で、適応患者の選択を行うこと。[17.1.32参照]
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
7.21 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
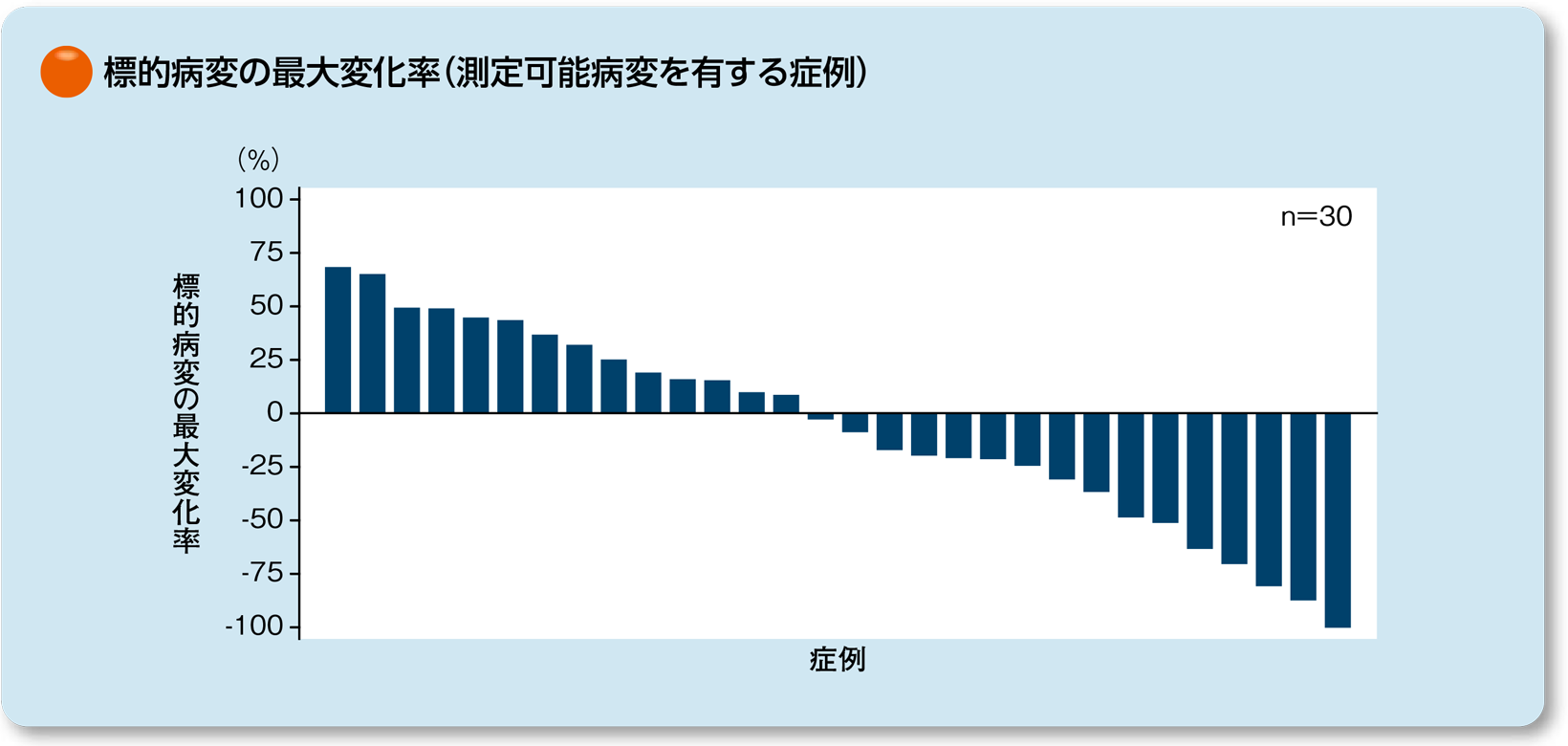
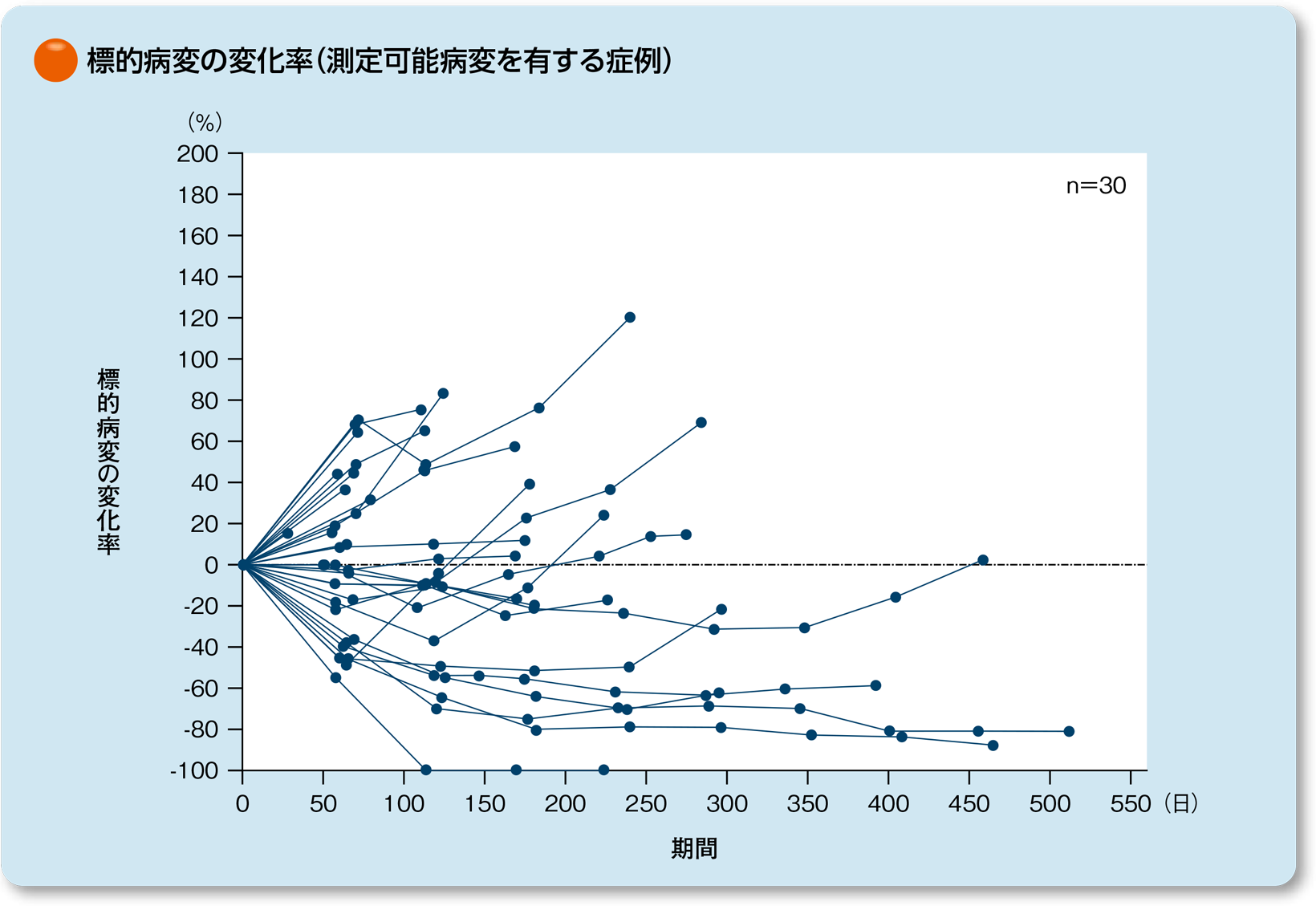
標的病変の最大変化率及び変化率[中央判定] 〔副次的評価項目〕
中央判定による測定可能病変を有する症例30例における標的病変の最大変化率及び変化率は下図の通りでした。
なお、変化率はRECISTガイドライン1.1版に基づき中央判定しました。
組織型別(有棘細胞癌、その他の組織型)の奏効率(ORR)[中央判定] 〔主要評価項目〕〔サブグループ解析〕
組織型別(有棘細胞癌、その他の組織型)の病勢コントロール率(DCR;CR+PR+SD)[中央判定] 〔副次的評価項目〕〔サブグループ解析〕
組織型別(有棘細胞癌、その他の組織型)の最良総合効果(BOR)[中央判定] 〔副次的評価項目〕〔サブグループ解析〕
組織型別(有棘細胞癌、その他の組織型)のサブグループ解析は以下の通りでした。
なお、抗腫瘍効果はRECISTガイドライン1.1版に基づき中央判定しました。
※:Clopper-Pearson法
4. 効能又は効果(一部抜粋)
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍
5. 効能又は効果に関連する注意(一部抜粋)
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
5.28 メルケル細胞癌患者に対する本剤の有効性及び安全性は確立していない。
5.29 臨床試験に組み入れられた患者の病理組織型等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解し
た上で、適応患者の選択を行うこと。[17.1.32参照]
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
7.21 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
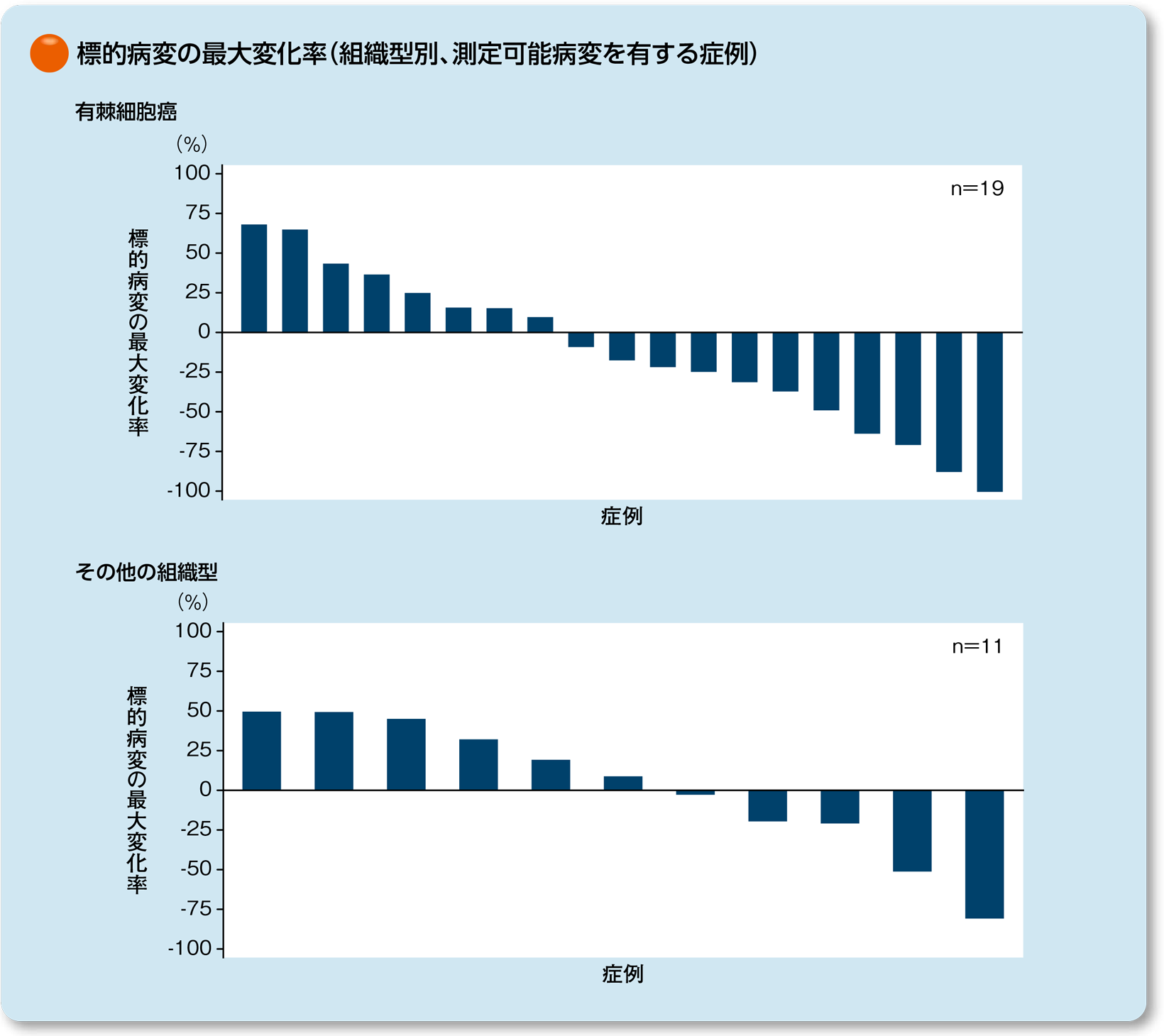
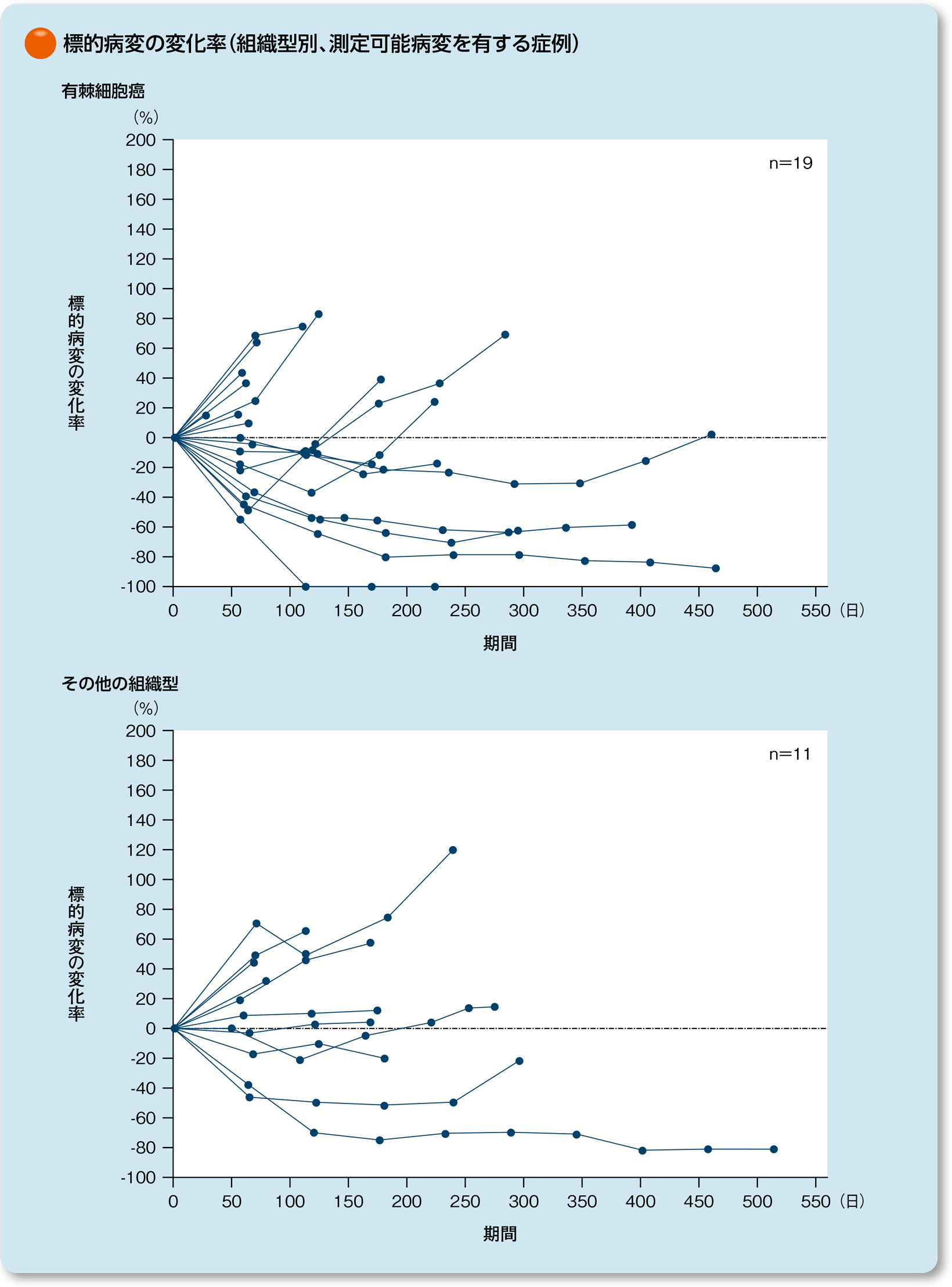
組織型別(有棘細胞癌、その他の組織型)の標的病変の最大変化率及び変化率[中央判定] 〔副次的評価項目〕〔サブグループ解析〕
中央判定による測定可能病変を有する症例(有棘細胞癌19例、その他の組織型11例)における標的病変の最大変化率及び変化率は以下の通りでした。
なお、変化率はRECISTガイドライン1.1版に基づき中央判定しました。
4. 効能又は効果(一部抜粋)
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍
5. 効能又は効果に関連する注意(一部抜粋)
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
5.28 メルケル細胞癌患者に対する本剤の有効性及び安全性は確立していない。
5.29 臨床試験に組み入れられた患者の病理組織型等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解し
た上で、適応患者の選択を行うこと。[17.1.32参照]
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
7.21 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
安全性
臨床検査値異常変動を含む副作用は58.1%(31例中18例)に認められました。
主な副作用(3例以上に発現)は、甲状腺機能亢進症及び血中甲状腺刺激ホルモン減少各12.9%(4例)、並びに甲状腺機能低下症及び発熱各9.7%(3例)でした。
重篤な副作用は12.9%(4例)に発現し、間質性肺疾患、甲状腺機能亢進症、肝機能異常及び発熱が各3.2%(1例)に認められました。
本試験において、投与中止に至った副作用は認められませんでした。
本試験において、死亡に至った副作用は認められませんでした。
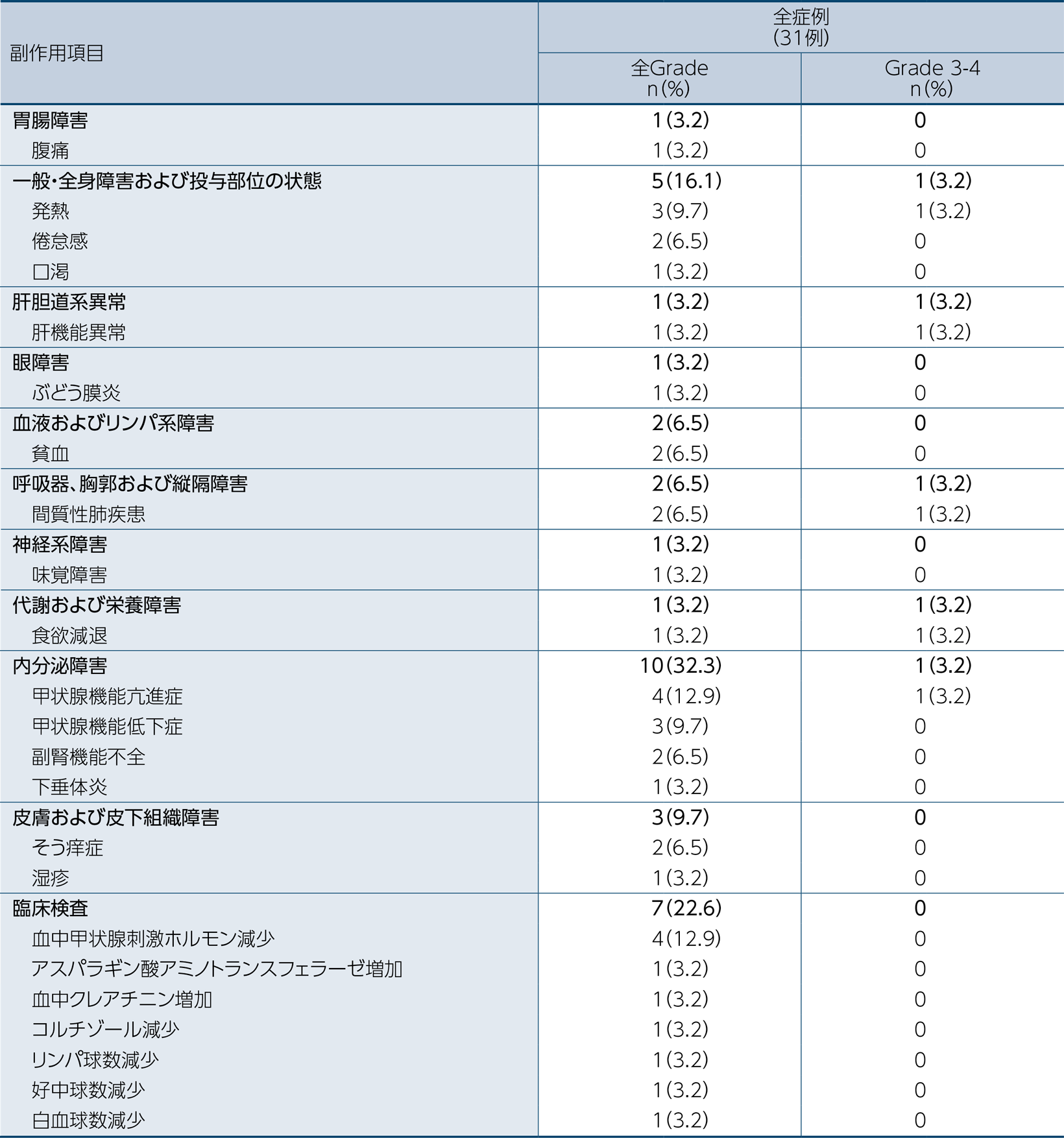
医師から報告された有害事象名はMedDRA ver 24.1Jを用いて読み替え、GradeはNCI-CTCAE ver 4.0を用いて評価しました。副作用の発現頻度は、治験薬の初回投与から治療期(治験薬の投与期間中)の終了28日後、後治療開始日又は治験中止日のいずれか早い方の日までに発現した全ての事象を対象に集計しました。
4. 効能又は効果(一部抜粋)
根治切除不能な進行・再発の上皮系皮膚悪性腫瘍
5. 効能又は効果に関連する注意(一部抜粋)
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
5.28 メルケル細胞癌患者に対する本剤の有効性及び安全性は確立していない。
5.29 臨床試験に組み入れられた患者の病理組織型等について、「17. 臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解し
た上で、適応患者の選択を行うこと。[17.1.32参照]
7. 用法及び用量に関連する注意(一部抜粋)
〈効能共通〉
7.1 本剤は、30分以上かけて点滴静注すること。
〈根治切除不能な進行・再発の上皮系皮膚悪性腫瘍〉
7.21 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。


